
TPE: LES ODEURS

UNE ODEUR DEGAGÉE PAR UNE ENTITE CHIMIQUE

TPE: LES ODEURS

L’odeur ressentie revient à des caractéristiques chimiques d’une molécule. En effet la plupart de ces molécules sont à base de carbone et d’hydrogène : elles sont organiques.
Sept éléments chimiques simples s’identifient :
-
Le fluor (F)
-
Le chlore (Cl)
-
Le brome (Br)
-
L’iode(I)
-
L’oxygène (O, sous forme d’ozone)
-
Le phosphore(P)
-
L’arsénique(As)


Ces derniers appelés atomes sont odorants sans aucune liaison ou modification chimique.
Dans la famille des molécules organiques deux branches y dérivent :
- D’une part les molécules oxygénées qui sont les plus odorantes :
-
Les aldéhydes : caractérisés par leur groupement –CHO (exemple : la vanilline à l'odeur de vanille)
-
Les cétones : caractérisés par leur groupement >C=O (exemple : civétone à l'odeur de musc)
-
Les esters : caractérisés par leur groupement RCOOR', R et R' différant selon les alcool/acide réagissant (exemple : coumarine à l'odeur d'herbe coupée).
- D'autre part les molécules non-oxygénées sous le nom d’hydrocarbures:
-
Les terpènes : caractérisés par leur groupement –CH (exemple : le pinène présente dans la menthe ou la sauge)
-
Les alcènes : caractérisés par leur groupement C=C (exemple : le limonène à l'odeur d'agrume)




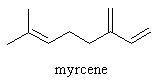
Cependant la classification de Zwaardermaker nous permet de classifier ces molécules sous neuf groupes différents :
-
Odeurs éthérées (fruits)
-
Odeurs aromatiques (camphre, amandes)
-
Odeurs fragrantes (fleurs)
-
Odeurs ambrosiaques (musc)
-
Odeurs alliacées (ail, soufre, chlore)
-
Odeurs empyreumatiques (odeurs de brûlé)
-
Odeurs capryliques (fromage, graisse, sueur)
-
Odeurs répulsives (punaise, belladone)
-
Odeurs nauséeuses (chair ou végétaux en décomposition, matières fécales)




Une molécule odorante n’est pas facilement caractérisée, plusieurs paramètres figurent contrairement à la lumière et au son.

Caracteristiques

d'une molecule

odorante
Tout d’abord ces molécules dites « volatiles », possèdent une masse molaire moyenne qui varie entre 30 à 300g/mol. Cette masse ni trop faible ni trop forte, facilite leur évaporation à température ambiante afin d’atteindre nos récepteurs olfactifs plus facilement.
Ensuite la concentration des molécules volatiles joue un rôle majeur ; chez l’homme, un seuil minimal est demandé pour pouvoir interpréter clairement une odeur. Plus précisément si la concentration est trop faible il n y a pas lieu de perception de celle-ci. À une concentration supérieure, le seuil de détection serra atteint mais c’est une odeur indéfinissable. À plus forte concentration, l’odeur devenue nette est alors comparée à une odeur déjà mémorisée. Le seuil de détection étant de 10-17mol/L peut atteindre dans certains cas exceptionnels 18mol/L.
Par suite la polarité est une caractéristique décrivant la répartition des charges négatives et positives dans un dipôle : plus les charges sont réparties de façon asymétriques plus une molécule sera polaire, et au contraire, si les charges sont réparties de façon totalement symétrique elle sera apolaire. Entre les deux, on trouve des composés plus ou moins polaires de polarité. Dans le cas des molécules odorantes on peut classer les composés en fonction d’une échelle de polarité :
Hydrocarbures (apolaires) ; Ethers (très peu polaires) ; Esters (peu polaires) ; Aldéhydes et cétones, alcools (plus polaires) ; Eau (très polaire).

Nous ne pouvons pas négliger la solubilité des molécules odorantes. Les molécules apolaires se solubilisent dans des solvants peu polaires ou apolaires, et vis-versa. Pour un arôme, la solubilisation va bien entendu, dépendre de la nature. Les molécules odorantes sont majoritairement faiblement polaires même apolaires, elles vont préférentiellement se solubiliser dans des solvants peu polaires ou apolaires comme les huiles, les graisses et certaines protéines que l’on appelle composés lipophiles. Ceci aura des conséquences sur les méthodes d'extraction des composés d'arômes et de ses composés.
En chimie organique, on parle d'isomérie lorsque deux molécules possèdent la même formule brute mais ont des formules semi-développées ou des formules développées différentes. L’isomérisation dans les molécules odorantes aboutit à des odeurs distinctes. . Ces molécules, appelées isomères, ont des propriétés physiques, chimiques et biologiques différentes. Ainsi, l'acétate d'isoamyle à l'odeur de banane est comparé à l'acide heptanoïque (odeur de gras). De formule C7H14O2, ce sont des isomères de fonctions : ester et acide.

Formule semie-développée de l'acétate d'isoamyle

Formule semie-développée de l'acide heptanoique
La chiralité, cette notion s’applique sur tous les objets qui nous entourent, pour les molécules, il s’agit de molécules ayant deux énantiomères (chacun des deux composés qui font une paire d'inverses) ou une molécule identique mais inversée ; c’est-à-dire ils ne sont pas superposables et leurs images sur le miroir sont inversées. Ils ne sont donc pas superposables mais possèdent les même propriétés chimiques et physiques, portent le même nom. Cependant, biologiquement ce changement tridimensionnel (par exemple un gant gauche qu’on ne peut pas enfiler à droite), est suffisant pour créer une perception différente malgré le fait que la molécule soit identique


Ces différentes caractéristiques nous ont lancé, nous les Hommes, vers la curiosité de récupérer les molécules odorantes, ainsi nées les méthodes d'extractions et la synthèse chimique.
Extrarction:
L’extraction est une technique qui permet de séparer une espèce chimique d’une autre, contenue dans un mélange liquide ou solide. Elle est utilisée généralement pour isoler, pour extraire, une espèce chimique particulière. Cependant en parfumerie, l'extrait obtenu est appelé « essence » ou « huile essentielle », comme exemple : l'huile essentielle de lavande qui est constituée d'une seule espèce chimique (l'acétate de linalyle), extraite de la fleur de lavande.
Pourtant il existe de nombreux types de techniques d'extraction qui peuvent être classées en deux groupes :

Les extractions ancestrales:
-
la décoction qui est une technique au cours de laquelle on immerge les plantes dans de l’eau froide, puis on porte l’ensemble à ébullition.
-
l’enfleurage qui est une technique permettant d’extraire les parfums des fleurs par dissolution dans des graisses.
-
la macération : une technique dont laquelle on immerge longuement des matières végétales ou animales dans un liquide froid afin d’en extraire les espèces chimiques solubles dans ce liquide.
-
l’infusion qui est aussi une technique qui consiste à verser de l’eau bouillante sur des feuilles ou des fleurs pour libérer leurs arômes.





Les extractions actuelles:
-
L’extraction par solvant qui permet d’extraire une espèce chimique d’un milieu solide ou liquide par solubilisation dans un solvant ainsi le solvant d’extraction doit être non miscible avec le liquide contenant l’espèce chimique à extraire qui à son tour doit être le plus soluble possible dans le solvant.
-
L’Hydrodistillation qui est la distillation d’un mélange d’eau et d’une espèce chimique à extraire. On porte le mélange à ébullition, la vapeur d’eau qui s’échappe du ballon se charge en huile essentielle. Au contact du réfrigérant à eau, le mélange eau-huile essentielle se condense, et on récupère le distillat. Pourtant, le distillat possède deux phases superposées, une phase aqueuse et une phase organique qui contient l’huile essentielle.




La synthèse:

En revanche, la synthèse en chimie a permis de reproduire des substances existant dans la nature comme par exemple des arômes ou des colorants. Une substance de synthèse est strictement identique à celle existant dans la nature et possède exactement les mêmes propriétés. Elle est également produite plus rapidement et en plus grande quantité ce qui permet au plus grand nombre de personnes d'en bénéficier.
Bien entendu que la synthèse d’une espèce chimique nécessite d’autres espèces chimiques. Les espèces chimiques nécessaires à la synthèse sont appelées : les réactifs de la synthèse et les espèces chimiques obtenues sont appelées : les produits de la synthèse. Les réactifs et les produits différents par leurs caractéristiques physiques. Cependant pour réaliser une synthèse, il faut suivre un protocole opératoire. Le montage le plus efficace pour la synthèse des aromes est: le chauffage a reflux. Il permet de travailler à une température élevée, d’accélérer la synthèse de l’espèce chimique et d’éviter les pertes de réactifs et de produits.
On distingue trois étapes lors de la synthèse:
-
L’introduction des réactifs
-
La transformation chimique,
-
L’extraction de l’espèce chimique synthétisée




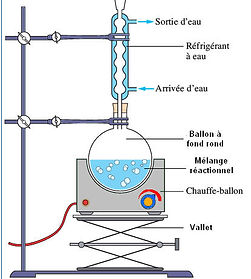
Montage a reflux

Pour mieux comprendre le principe d’extraction et de synthèse, nous avons décidé de réaliser un type des techniques d’extraction : l’hydrodistillation de lavande et ensuite de le synthétiser afin de comparer les deux odeurs.
Remonter
